臨床研究・医学研究の
賠償責任保険
臨床研究・医学系研究における予期せぬリスクに備え、
研究者と被験者の双方を守る安心の補償をご提供します。
はじめに: 補償体制の必要性
臨床研究および医学系研究は、医療の発展や新たな治療法の確立に不可欠な営みです。 しかしその一方で、研究対象者(被験者)に対する安全配慮と健康被害が生じた場合の補償体制の整備は、 研究の信頼性と倫理性を担保する上で極めて重要な要素です。
特に現代の医療研究においては、社会的説明責任や被験者の権利尊重が強く求められており、 補償体制の不備は研究そのものの継続を困難にする要因ともなり得ます。
本邦における臨床研究/臨床試験/治験の位置付け
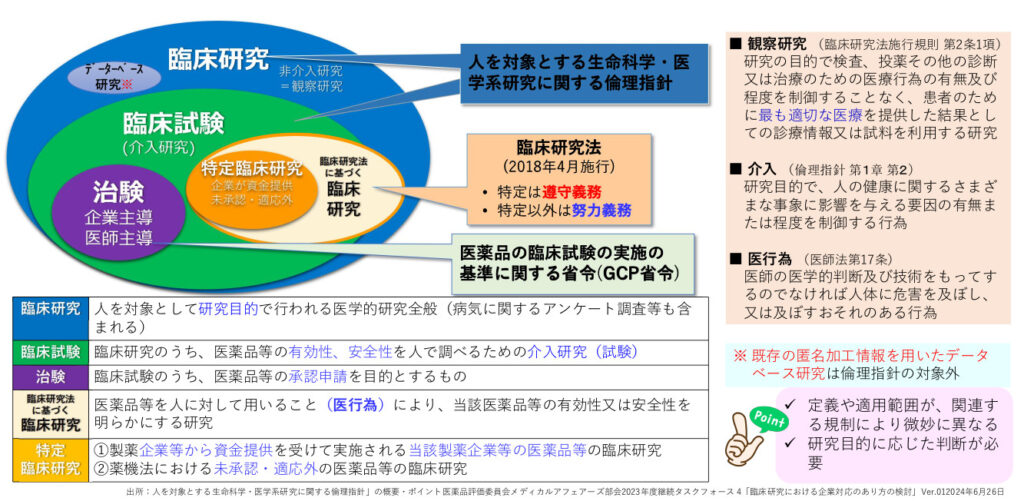
臨床研究の類型と適用規制
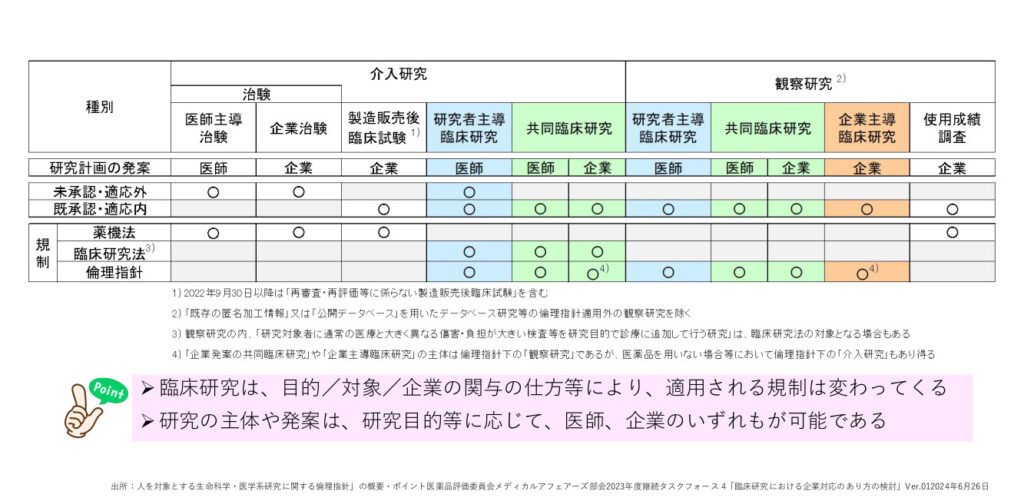
倫理的・法的な根拠
臨床研究法に基づく
補償義務
臨床研究法(平成29年法律第16号)は、特定臨床研究を中心に研究の質と安全性を確保するための枠組みを提供しています。この中で義務付けられている実施計画において、健康被害が生じた場合の補償及び医療の提供に関する事項があります。
GCP省令における
補償義務
医薬品の臨床試験に関する実施基準(GCP) 第1条では、被験者の人権、安全および福祉の保護が基本原則として定められており、これはすべての研究関係者に課せられる普遍的な義務です。第14条では、治験依頼者が被験者に対する補償措置を講じる義務が明文化されており、臨床試験を実施する企業・機関がその責任主体であることが明示されています。
厚生労働省の通知
厚生労働省の通知でも、臨床研究に際し、被験者の安全性確保のために保険等による補償措置を講じることが求められており、実務的にも保険加入はほぼ必須の要件とされています。(厚生労働省令臨床研究法施行規則第20条)
倫理指針に基づく
補償義務
『人を対象とする医学系研究に関する倫理指針』第2章研究者等の責務等では、研究により健康被害等が生じた場合には、研究責任者およびその所属機関が補償責任を負うことが定められています。これは倫理審査における重要な評価項目のひとつでもあります。
補償体制を講じない場合のリスク
補償体制が不備な場合、倫理審査委員会の承認が得られず、研究の実施が不可能となるおそれがあります。 また、研究機関としての信頼性低下や、将来的な研究審査体制に悪影響を及ぼす可能性があります。
法令違反に対する罰則 (臨床研究法関連)
・厚生労働大臣による指導・勧告
・研究の実施停止、名称公表
・命令違反時には刑事罰(1年以下の懲役または100万円以下の罰金)
補償の範囲と具体例
(医法研補償ガイドライン)
補償項目
・医療費
・医療手当
・補償金
1. 障害補償金
2. 遺族補償金
3. 休業補償金
(健康人対象実験の場合)など
補償の対象外となる例
・被験者自身による故意または重大な過失による被害
・効能不発揮によるもの
・因果関係が合理的に否定される場合
・プラセボ投与
医師賠償責任保険との違い
Q & A
1. 補償体制の必要性に関する質問
-
なぜ臨床試験や臨床研究では賠償責任保険が必要なのですか?
-
臨床試験や研究では、予期せぬ副作用や健康被害が発生する可能性があります。被験者保護の観点から、補償体制を整えていない研究は実施できません。賠償責任保険は、こうしたリスクに備え、迅速かつ公平な補償を行うために不可欠です。
-
法律や規制で補償は義務づけられていますか?
-
はい。臨床研究法やGCP省令により、研究責任者や治験依頼者は、被験者に健康被害が発生した場合に備えた補償措置を講じることが義務付けられています。
2. 加入対象・契約形態
-
誰が加入する必要がありますか?
-
臨床研究法やGCP省令の対象となる研究を実施する機関・企業が加入します。大学・研究機関、製薬企業、スタートアップ企業、CROなどが主な対象です。
3. 実務的な流れ
-
加入の手続きにはどのような書類が必要ですか?
-
一般的には研究計画書、倫理審査委員会への申請資料、被験者数などの情報が必要です。これらを基に保険会社が補償内容・保険料を算定します。
-
倫理審査委員会(IRB)に提出する保険証券はどのタイミングで準備すべきですか?
-
研究開始前にIRBへ提出する必要があります。保険加入が確認できない場合、倫理審査の承認は得られません。
4. トラブル・事故発生時の対応
-
実際に被験者に健康被害が生じた場合、どのような流れで補償が行われますか?
-
研究機関または依頼者が状況を確認し、速やかに保険会社へ報告します。その後、 事故の状況について詳細を確認し、必要な書類を提出。書類をもとに保険金の支払い可否を審査し、補償範囲と保険金額を確定した上で保険金をお支払いします。
5. コスト・運用
-
保険料はどのように決まりますか?
-
被験者数、研究内容、実施期間、リスクの程度などをもとに算定されます。リスクが高い研究ほど保険料も高くなる傾向があります。
-
スタートアップ企業でも加入可能ですか?
-
はい、可能です。研究規模や予算に応じたプランを選ぶことができます。助成金や補助制度を利用して保険料負担を軽減できる場合もあります。
臨床研究・医学研究賠償責任保険のご案内
当社では、研究中の事故や損害に備えた『医学研究賠償責任保険』をご提供しており、 これまで200件を超える研究案件においての実績がございます。
各種研究内容や規模に応じたご提案が可能ですので、まずはお気軽にご相談ください。
臨床研究・医学研究賠償責任保険チーム
お問い合わせ
臨床研究・医学研究賠償責任保険に関するご質問や、お見積もりのご依頼はこちらからどうぞ。

2025年7月1日 株式会社アステクトは、三井住友海上の「MSプロフェッショナルTGA(Top Grade Agent)」代理店に認定されました。
MSプロフェッショナル認定制度とは、三井住友海上が厳正な審査により「お客さま対応」「経営姿勢」「業務品質」「組織体制」などの諸要件を満たした
トップクラスのプロ代理店を認定する制度で、A・AA・AAA・TGA等の認定ランクがあります。
MSプロフェッショナルTGA代理店は、その中の「最上位の認定ランク」で三井住友海上火災保険(株)の全国約3万社の代理店の中で、独立系代理店では、20社ほどしか認定されておりません。
株式会社アステクト
渋谷本社 :03-3409-5013
東京南支店:03-5762-8600
平日9:00 ~ 18:00(土日・祝日は休み)
出典・参考資料
・医薬品企業法務研究会『被験者の健康被害補償に関するガイドライン Q&A集(2016年3月改訂版)』
・『人を対象とする医学系研究に関する倫理指針』
・厚生労働省「臨床研究法」および「臨床研究法施行規則」
・「人を対象とする生命科学・医学系研究に関する倫理指針」の概要・ポイント医薬品評価委員会
メディカルアフェアーズ部会2023年度継続タスクフォース4 「臨床研究における企業対応のあり方の検討」
Ver.012024年6月26日
※本ページの内容は、2025年6月時点の法令・ガイドラインに基づいて作成されており、将来的に改正される可能性があります。詳細については、各関係機関または当社窓口までお問い合わせください。